薬機法とは?
薬機法(やっきほう)とは、医薬品、医薬部外品、化粧品、医療機器及び再生医療機器等製品に関するルールを定めるものです。
こうした医薬品等は人の身体の中に取り込んだり、直接肌に使用したりするものですので、その販売についてや広告の仕方などを適切に定めておかないと健康被害が生じたりしてしまいます。
そこで、薬機法という法律が整備されているのです。
2021年8月施政から薬機法が改正!ポイントは?
旧薬事法が改められて制定された薬機法ですが、2020年に一部改正が加えられ、2020年4月1日からスタートした医薬品用の覚醒剤原料の輸入許可制度を皮切りに、2020年9月1日には「先駆け審査指定制度」や「条件付き早期承認制度」が始まるなど、少しずつ新しい制度が始まっています。
このような動きの中で、2021年8月1日からスタートした(「施行」といいます)新しい制度もいくつかあります。
今回の2021年8月1日から施行された様々な制度は、大きく分けると、以下の3つのタイプに分けられます。
- ① 医薬品、医療機器等をより安全・迅速・効率的に提供するための制度の改善
- ② 薬剤師・薬局の見直し
- ③ 信頼確保のための制度の改善
参照:厚生労働省|医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和元年法律第63号)の概要
① 医薬品、医療機器等をより安全・迅速・効率的に提供するための制度の改善
まず、①についてですが、医薬品等は人体に及ぼす影響の大きさから、慎重に治験等を重ねることでその有効性や安全性が十分に確認されないと、製品として「承認」されません(薬機法第14条等)。
2022年2月現在、新型コロナウイルスに対する国内産の治療薬の開発が進んでいますが、ニュースでたびたび「承認」申請という言葉が出てきますが、この申請こそ、薬機法に関わるものです。
このように、医薬品等の承認はとても大変な手続なのですが、しかし、事前に承認を得た製造方法等に関して、承認を得た後に変更を加える必要が出てくることも当然あり得ます。
このような場合、改正前では更に変更内容について、厚生労働大臣の承認を改めて得る必要がありました。
2021年8月1日から施行された改正薬事法では、安全性を十分に確保しつつも、より迅速に製造方法等を変更できるような仕組みが取られています。
具体的には、これまでと異なり、承認制ではなく、届出制となります。
 届出制の内容
届出制の内容![]()
また、医薬品等の安全性をより高めるためにも、迅速な情報のアップデートは重要となります。
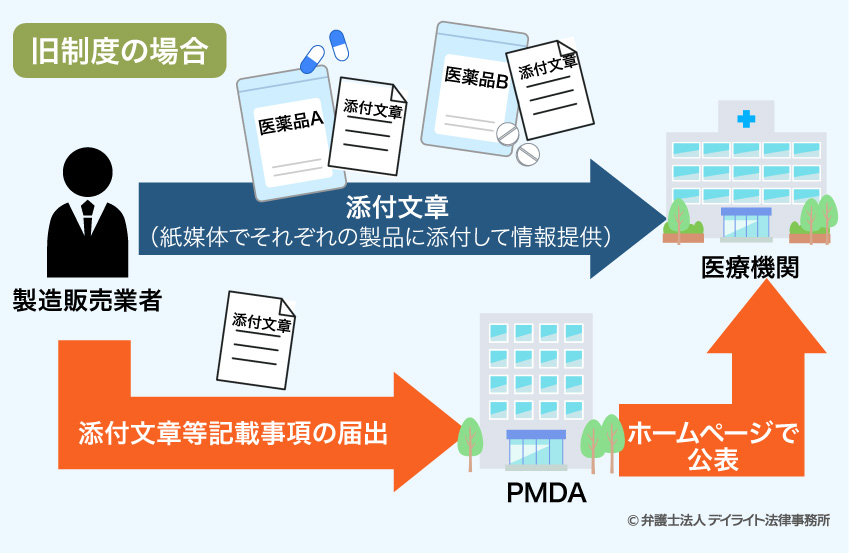
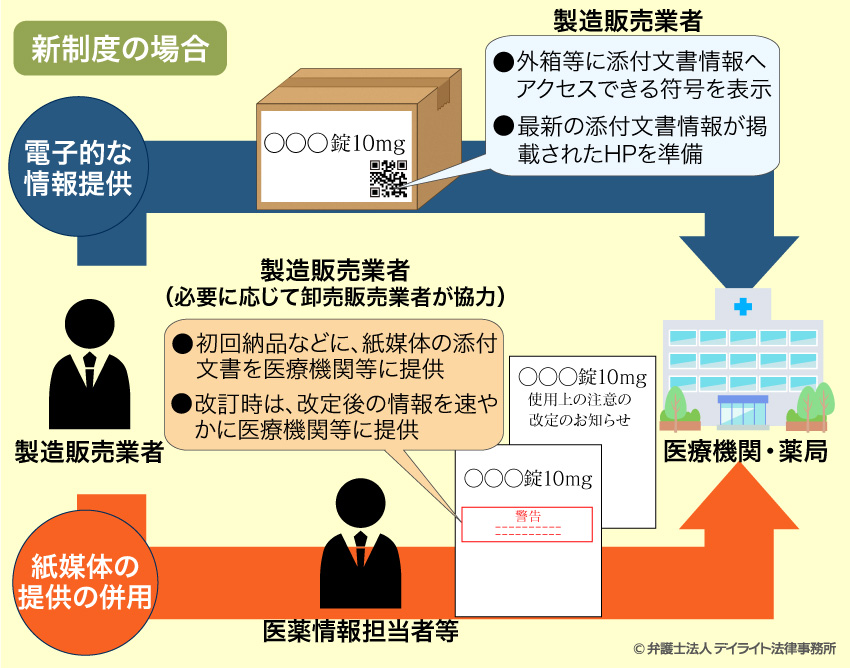
そのために、医薬品等の注意事項等の情報を、これまでは紙媒体で医薬品等の製品に添付されていましたが(ただし、医療用医薬品、要指導医薬品、高度管理医療機器については、既に独立行政法人医薬品医療機器総合機構(PMDA)という機関のホームページを通して公表されることとなっています。)、2021年8月1日からは原則としてデータの形で提供することと改められました(2023年7月31日までは移行期間で、本格始動は2023年8月からとなります)。
具体的には、医療用医薬品等と同様に、PMDAのホームページで公表されることとなります。
そのため、医薬品等の製造に関わる業者は、このデータにアクセスできるようなコード情報等を製品の容器などに記載するなど、製品を購入する者に情報を提供できるように体制を整えることが求められています(法第52条1項、第63条の2第1項、第65条の3及び第68条の2、第68条の2の2等)。ペーパーレスの時流にも合致しています。
ただし、あくまでもデータによる情報提供が原則となるだけで、紙媒体での情報提供が一切なくなるわけではありません。
例えば、ドラッグストアで販売されているような一般用医薬品等(処方箋が不要で消費者が直接購入できるもの)については、注意事項などの情報をすぐに確認できる状態を確保する必要があるため、紙媒体の説明書きは引き続き添付されます(改正後薬機法則第210条の3)。
したがって、一般消費者が医薬品等を購入する場合にはそれほど大きな違いはありません。
参考:厚生労働省医薬・生活衛生局長|医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を 改正する法律の一部の施行に伴う関係省令の整備等に関する省令の公布について
② 薬剤師と薬局のあり方の見直し
次に、②についてです。例えば、病院で医師から医薬品の処方を受けた場合、処方箋を持って薬局に行き、そこで医薬品などを入手することになると思います。
そこで、どの薬局に行けばよいのか…と思われたことは、一度はあるのではないでしょうか。
そういう場合に、薬を服用する人自身が、自分により適した薬局を選択できるように、機能別に薬局の名称を掲げられるようになりました(都道府県知事の認定が必要です)。
③ 信頼確保のための制度の改善(課徴金制度の創設等)
次に、③に関してですが、より安心して医薬品等を利用できるように、2021年8月1日から、医薬品等に関係する業者が、法令をより守れる体制に強化されました。
具体的には以下の2点にまとめられます。
- ア 許可等業者に対する法令遵守体制の整備を義務付け
- イ 虚偽・誇大広告による医薬品等の販売に対する課徴金制度の創設
まず、アについては、医薬品等に関わる業者として許可を受けた者が、製造販売過程で法令を守れるよう、体制を構築することが義務として定められています。
例えば、業務監督体制を整備すること、経営陣と現場責任者の責任の範囲を明確に分けることなどが定められています(法第9条の2第1項各号、第18条の2第1項各号及び第3項各号、第 23 条の2の 15 の2第1項各号及び第3項各など))。
人体に影響のある医薬品等ですので、ガバナンス体制をしっかり構築して健康被害等が生じないに国としてしっかりと法整備を行うという姿勢を示す改正といえます。
ポイント:誤った記載や効果を過大に記載した表現を行うと薬機法の改正により刑事罰だけでなく課徴金も科される可能性がある!
課徴金の金額は、広告を掲載した期間に6ヶ月を加えた期間で取引した対象の医薬品等の対価合計額の4.5%とされています。
例えば、2022年1月1日から同月31日まで、Aという薬品に関して誇大表現の広告を掲載した場合、1月31日から6か月を加えた、2022年1月1日から同年2022年7月31日までの間で薬品Aを販売して得た金額の総額に、4.5%をかけた金額が、課徴金として納付しなければならない金額となります。(減額される場合や、課徴金が命じられない場合もありますが、例外的です。)
虚偽の広告については、景品表示法でも同じように課徴金制度が定められていますが、薬機法に基づいて課せられる課徴金とは別物で、どちらも重複して課せられる場合もありえます(ただし、その場合には金額が減額されます)。
薬機法改正、今後のスケジュール
様々な内容を含む薬機法改正ですが、さらに2022年の12月1日からは、トレーサビリティの向上のために、医薬品等の包装等にバーコード等の表示をつけることが義務付けられることが予定されています。
トレーサビリティとは、製造から保管、販売に至るまでの流通経緯を追跡できることを意味しています。
トレーサビリティが向上することによって、製品がいつ、どこの工場のどのロットで製造されたのか、そしてどこの工場で保管されたのか等の医薬品等の「歴史」を追うことが可能となります。
例えば、新型コロナワクチンで異物混入が騒がれたことが記憶に新しいですが、その際にも、「どこの工場のどのロットで…」という情報が公表されていました。
このトレーサビリティが整備されたことで、異物混入の情報が流通ラインに関わる人たちに迅速に共有でき、効率よく回収できたのだといえます。
薬機法の違反を防ぐには?
病気を治すためにある医薬品等が健康を害するという悲劇を回避しつつも、なるべく早く必要な人に効率よく治療の手段を届けたい…そんな目的のために、薬機法は緻密に定められています。
そして、医薬品等の製品の安全性を高めるために、製造・販売・保管に関わる業者には様々な義務や手続が課されています。
そして、医薬品等に関する情報の記載には、消費者の誤解を招かないように、誇大な表示や虚偽の表示は一層厳しく規制されています。
目の前で行われていることに関して、「安全性」を優先事項に据えて行動することが、薬機法違反を回避するためにはベストでしょう。
まとめ
2021年8月から施行された改正薬機法の内容について、説明してきましたが、たくさんの例外的な規定や、細かな規定がまだまだあります。
薬機法の規定は大変緻密で、違反の結果も重大となりかねません。
したがって、迷われた際には、ぜひお気軽に弁護士にご相談ください。